07 กันยายน 2552
ธาตุเคมี (อังกฤษ: Chemical element) หรือนิยมเรียกว่า ธาตุ คือสสารที่ไม่อาจแบ่งแยกหรือเปลี่ยนแปลงให้เป็นสสารอื่นได้ด้วยวิธีทางเคมีทั่วไป อนุภาคที่เล็กที่สุดของธาตุเรียกว่า อะตอม ซึ่งประกอบด้วยอิเล็กตรอนวิ่งวนรอบนิวเคลียสที่ประกอบด้วยโปรตอนและนิวตรอน
เลขอะตอมของธาตุ (ใช้สัญลักษณ์ Z) คือ จำนวนของโปรตอนในอะตอมของธาตุ ตัวอย่างเช่น เลขอะตอมของธาตุคาร์บอน นั้นคือ 6 ซึ่งหมายความว่า อะตอมของคาร์บอนนั้นมีโปรตอนอยู่ 6 ตัว ทุกๆอะตอมของธาตุเดียวกันจะมีเลขอะตอมเท่ากันเสมอ ซึ่งก็คือมีจำนวนโปรตอนเท่าๆกัน แต่อะตอมของธาตุชนิดเดียวกันอาจมีจำนวนนิวตรอนไม่เท่ากัน ซึ่งเรียกว่า ไอโซโทปของธาตุ มวลของอะตอม (ใช้สัญลักษณ์ A) นั้นวัดเป็น หน่วยมวลอะตอม (unified atomic mass units) (ใช้สัญลักษณ์ u) ซึ่งเท่ากับผลรวมของจำนวนโปรตอน และ นิวตรอนในนิวเคลียสของอะตอม ธาตุบางประเภทนั้นจะเป็น สารกัมมันตรังสี และมีการเปลี่ยนแปลงเป็นธาตุชนิดอื่น เนื่องจากการสลายตัวทางกัมมันตภาพรังสี
ธาตุที่เบาที่สุดคือ ไฮโดรเจน และ ฮีเลียม ซึ่งเป็นสองธาตุแรกสุดที่เกิดขึ้นในกระบวนการบิ๊กแบง ธาตุอื่นๆนั้นเกิดขึ้นตามธรรมชาติหรือสร้างขึ้นด้วยมนุษย์ด้วยวิธีการต่าง ๆ ในการสังเคราะห์นิวเคลียส
จนถึงปี ค.ศ. 2004 มีธาตุที่ถูกค้นพบทั้งหมด 116 ธาตุ (ดู ตารางธาตุ) ในจำนวนนี้มี 91 ธาตุที่เกิดขึ้นตามธรรมชาติ ส่วน 25 ธาตุที่เหลือนั้นเป็นธาตุที่ถูกสร้างขึ้น โดยธาตุแรกที่ถูกสร้างขึ้นคือเทคนีเชียม ในปี ค.ศ. 1937 ธาตุที่ถูกสร้างขึ้นนี้ ทั้งหมดเป็นธาตุกัมมันตภาพรังสี ที่มีระยะครึ่งชีวิตที่สั้น ดังนั้นธาตุเหล่านี้ที่เกิดขึ้นมาพร้อมกับโลกนั้น ก็ได้สลายตัวไปหมดแล้ว
อะตอมของธาตุเดียวกันที่มีจำนวนนิวตรอนไม่เท่ากันนั้นจะเรียกว่าเป็น ไอโซโทปของธาตุนั้น
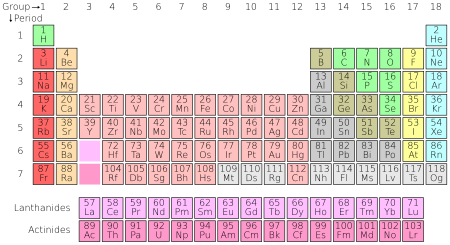
สมบัติของธาตุในตารางธาตุ
 ธาตุในหมู่ (Group) เดียวกัน
ธาตุในหมู่ (Group) เดียวกัน
 Valence Electron เท่ากัน
Valence Electron เท่ากัน
 พลังงาน IE ลดลงจากบนลงล่าง
พลังงาน IE ลดลงจากบนลงล่าง
 ค่า EN (Electronegativity) ลดลงจากบนลงล่าง
ค่า EN (Electronegativity) ลดลงจากบนลงล่าง
 ธาตุในคาบ (Period) เดียวกัน
ธาตุในคาบ (Period) เดียวกัน
 Valence Electron เพิ่มขึ้นจากซ้ายไปขวา
Valence Electron เพิ่มขึ้นจากซ้ายไปขวา
 พลังงาน IE เพิ่มขึ้นจากซ้ายไปขวายกเว้นหมู่ 2 สูงกว่าหมู่ 3 และ หมู่ 5 สูงกว่าหมู่ 6
พลังงาน IE เพิ่มขึ้นจากซ้ายไปขวายกเว้นหมู่ 2 สูงกว่าหมู่ 3 และ หมู่ 5 สูงกว่าหมู่ 6
 ค่า EN เพิ่มขึ้นจากซ้ายไปขวา
ค่า EN เพิ่มขึ้นจากซ้ายไปขวา
เลขอะตอมของธาตุ (ใช้สัญลักษณ์ Z) คือ จำนวนของโปรตอนในอะตอมของธาตุ ตัวอย่างเช่น เลขอะตอมของธาตุคาร์บอน นั้นคือ 6 ซึ่งหมายความว่า อะตอมของคาร์บอนนั้นมีโปรตอนอยู่ 6 ตัว ทุกๆอะตอมของธาตุเดียวกันจะมีเลขอะตอมเท่ากันเสมอ ซึ่งก็คือมีจำนวนโปรตอนเท่าๆกัน แต่อะตอมของธาตุชนิดเดียวกันอาจมีจำนวนนิวตรอนไม่เท่ากัน ซึ่งเรียกว่า ไอโซโทปของธาตุ มวลของอะตอม (ใช้สัญลักษณ์ A) นั้นวัดเป็น หน่วยมวลอะตอม (unified atomic mass units) (ใช้สัญลักษณ์ u) ซึ่งเท่ากับผลรวมของจำนวนโปรตอน และ นิวตรอนในนิวเคลียสของอะตอม ธาตุบางประเภทนั้นจะเป็น สารกัมมันตรังสี และมีการเปลี่ยนแปลงเป็นธาตุชนิดอื่น เนื่องจากการสลายตัวทางกัมมันตภาพรังสี
ธาตุที่เบาที่สุดคือ ไฮโดรเจน และ ฮีเลียม ซึ่งเป็นสองธาตุแรกสุดที่เกิดขึ้นในกระบวนการบิ๊กแบง ธาตุอื่นๆนั้นเกิดขึ้นตามธรรมชาติหรือสร้างขึ้นด้วยมนุษย์ด้วยวิธีการต่าง ๆ ในการสังเคราะห์นิวเคลียส
จนถึงปี ค.ศ. 2004 มีธาตุที่ถูกค้นพบทั้งหมด 116 ธาตุ (ดู ตารางธาตุ) ในจำนวนนี้มี 91 ธาตุที่เกิดขึ้นตามธรรมชาติ ส่วน 25 ธาตุที่เหลือนั้นเป็นธาตุที่ถูกสร้างขึ้น โดยธาตุแรกที่ถูกสร้างขึ้นคือเทคนีเชียม ในปี ค.ศ. 1937 ธาตุที่ถูกสร้างขึ้นนี้ ทั้งหมดเป็นธาตุกัมมันตภาพรังสี ที่มีระยะครึ่งชีวิตที่สั้น ดังนั้นธาตุเหล่านี้ที่เกิดขึ้นมาพร้อมกับโลกนั้น ก็ได้สลายตัวไปหมดแล้ว
อะตอมของธาตุเดียวกันที่มีจำนวนนิวตรอนไม่เท่ากันนั้นจะเรียกว่าเป็น ไอโซโทปของธาตุนั้น
สมบัติของธาตุในตารางธาตุ

4 ธาตุ น่าสนใจ
อาร์กอน (อังกฤษ: Argon) เป็นธาตุเคมีในตารางธาตุที่มีสัญลักษณ์ Ar
และเลขอะตอม 18 เป็นก๊าซมีตระกูลตัวที่ 3 อยู่ในกลุ่ม 18
ก๊าซอาร์กอนประกอบเป็น 1% ของบรรยากาศของโลก

ข้อมูลทั่วไปของ Ar


ข้อมูลทั่วไปของ Os
ชื่อ, สัญลักษณ์, หมายเลข=ออสเมียม, Os, 76
อนุกรมเคมี=โลหะทรานซิชัน
หมู่, คาบ, บล็อก=8, 6, d
ลักษณะ=silvery, blue cast
มวลอะตอม=190.23(3) กรัม/โมล
การจัดเรียงอิเล็กตรอน=[Xe] 4f14 5d6 6s2
อิเล็กตรอนต่อระดับพลังงาน=2, 8, 18, 32, 14, 2
คุณสมบัติทางกายภาพ
สถานะ=ของแข็ง
ความหนาแน่น (ใกล้ r.t.)=22.61 ก./ซม.³
ความหนาแน่นของของเหลวที่m.p.=20 ก./ซม.³
จุดหลอมเหลว=3306 K(3033 °C)
จุดเดือด=5285 K(5012 °C)
ความร้อนของการหลอมเหลว=7.85 กิโลจูล/โมล
ความร้อนของการกลายเป็นไอ=738 กิโลจูล/โมล
ความร้อนจำเพาะ=(25 °C) 24.7 J/(mol·K)
ความดันไอ
คุณสมบัติของอะตอม
อื่น ๆ
การจัดเรียงทางแม่เหล็ก=?
ความต้านทานไฟฟ้า=(0 °C) 81.2 nΩ·m
การนำความร้อน=(300 K) 87.6 W/(m·K)
การขยายตัวจากความร้อน=(25 °C) 5.1 µm/(m·K)
ความเร็วเสียง (ท่อนบาง)=(20 °C) 4940 m/s
โมดูลัสของแรงเฉือน=222 GPa
อัตราส่วนปัวซอง=0.25
โมดูลัสของแรงบีบอัด=462 GPa
ความแข็งโมห์ส=7.0
ความแข็งบริเนล=3920 MPa
เลขทะเบียน CAS=7440-04-2
ไอโซโทปที่น่าสนใจ
บทความหลัก: ไอโซโทปของออสเมียม
iso NA ครึ่งชีวิต DM DE (MeV) DP
184Os 0.02% >5.6 E13 y α ? 180W
185Os syn 93,6 d ε 1.013 185Re
186Os 1.58% >2.0 E15 y α 2.822 182W
187Os 1.6% Os เสถียร โดยมี 111 นิวตรอน
188Os 13.3% Os เสถียร โดยมี 112 นิวตรอน
189Os 16.1% Os เสถียร โดยมี 113 นิวตรอน
190Os 24.6% Os เสถียร โดยมี 114 นิวตรอน
191Os syn 15.4 d β- 0.314 191Ir
192Os 41.0% Os เสถียร โดยมี 116 นิวตรอน
193Os syn 30.11 d β- 1.141 193Ir
194Os syn 6 y β- 0.097 194Ir


ข้อมูลทั่วไปของ Re
ชื่อ, สัญลักษณ์, หมายเลข=รีเนียม, Re, 75
อนุกรมเคมี=โลหะทรานซิชัน
หมู่, คาบ, บล็อก=7, 6, d
ลักษณะ=สีขาวอมเทา
มวลอะตอม=186.207 (1) กรัม/โมล
การจัดเรียงอิเล็กตรอน=[Xe] 4f14 5d5 6s2
อิเล็กตรอนต่อระดับพลังงาน=2, 8, 18, 32, 13, 2
คุณสมบัติทางกายภาพ
คุณสมบัติของอะตอม
โครงสร้างผลึก=hexagonal
สถานะออกซิเดชัน=6, 4, 2, −2(ออกไซด์เป็นกรดปานกลาง)
อิเล็กโตรเนกาติวิตี=1.9 (พอลิงสเกล)
พลังงานไอออไนเซชัน(เพิ่มเติม)
ไอโซโทปที่น่าสนใจ
บทความหลัก: ไอโซโทปของรีเนียม
iso NA ครึ่งชีวิต DM DE (MeV) DP
185Re 37.4% Re เสถียร โดยมี 110 นิวตรอน 
 โลหะสังกะสี
โลหะสังกะสี
ข้อมูลทั่วไปของ Zn
ชื่อ, สัญลักษณ์, หมายเลข=สังกะสี, Zn, 30
อนุกรมเคมี=โลหะทรานซิชัน
หมู่, คาบ, บล็อก=12, 4, d
ลักษณะ=สีเทาอ่อนแกมน้ำเงิน
มวลอะตอม=65.409 (4) กรัม/โมล
การจัดเรียงอิเล็กตรอน=[Ar] 3d10 4s2
อิเล็กตรอนต่อระดับพลังงาน=2, 8, 18, 2
คุณสมบัติทางกายภาพ
สถานะ=ของแข็ง
ความหนาแน่น (ใกล้ r.t.)=7.14 ก./ซม.³
ความหนาแน่นของของเหลวที่m.p.=6.57 ก./ซม.³
จุดหลอมเหลว=692.68 K(419.53 °C)
จุดเดือด=1180 K(907 °C)
ความร้อนของการหลอมเหลว=7.32 กิโลจูล/โมล
ความร้อนของการกลายเป็นไอ=123.6 กิโลจูล/โมล
ความร้อนจำเพาะ=(25 °C) 25.390 J/(mol·K)
ความดันไอ
P/Pa 1 10 100 1 k 10 k 100 k
ที่ T K 610 670 750 852 990 (1185)
คุณสมบัติของอะตอม
โครงสร้างผลึก=หกเหลี่ยม
สถานะออกซิเดชัน=2(amphoteric oxide)
อิเล็กโตรเนกาติวิตี=1.65 (พอลิงสเกล)
พลังงานไอออไนเซชัน(เพิ่มเติม)
ระดับที่ 1: 906.4 กิโลจูล/โมล
ระดับที่ 2: 1733.3 กิโลจูล/โมล
ระดับที่ 3: 3833 กิโลจูล/โมล
รัศมีอะตอม=135 pm
รัศมีอะตอม (คำนวณ)=142 pm
รัศมีโควาเลนต์=131 pm
รัศมีวานเดอร์วาลส์=139 pm
อื่น ๆ
การจัดเรียงทางแม่เหล็ก=diamagnetic
ความต้านทานไฟฟ้า=(20 °C) 59.0 nΩ·m
การนำความร้อน=(300 K) 116 W/(m·K)
การขยายตัวจากความร้อน=(25 °C) 30.2 µm/(m·K)
ความเร็วเสียง (thin rod)=(r.t.) (rolled) 3850 m/s
โมดูลัสของยังก์=108 GPa
โมดูลัสของแรงเฉือน=43 GPa
โมดูลัสของแรงบีบอัด=70 GPa
อัตราส่วนปัวซอง=0.25
ความแข็งโมห์ส=2.5
ความแข็งบริเนล=412 MPa
เลขทะเบียน CAS=7440-66-6
และเลขอะตอม 18 เป็นก๊าซมีตระกูลตัวที่ 3 อยู่ในกลุ่ม 18
ก๊าซอาร์กอนประกอบเป็น 1% ของบรรยากาศของโลก

ข้อมูลทั่วไปของ Ar

มวลอะตอม= 39.948 (1) กรัม/โมล
คุณสมบัติทางกายภาพ
สถานะ =ก๊าซ
จุดหลอมเหลว =83.80 K(-189.35 °C)
จุดเดือด =87.30 K(-185.85 °C)
ความร้อนของการหลอมเหลว= 1.18 กิโลจูล/โมล
ความร้อนของการกลายเป็นไอ= 6.43 กิโลจูล/โมล
ความร้อนจำเพาะ=(25 °C) 20.786 J/(mol·K)
สถานะ =ก๊าซ
จุดหลอมเหลว =83.80 K(-189.35 °C)
จุดเดือด =87.30 K(-185.85 °C)
ความร้อนของการหลอมเหลว= 1.18 กิโลจูล/โมล
ความร้อนของการกลายเป็นไอ= 6.43 กิโลจูล/โมล
ความร้อนจำเพาะ=(25 °C) 20.786 J/(mol·K)
P/Pa 1 10 100 1 k 10 k 100 k
ที่ T K - 47 53 61 71 87
ที่ T K - 47 53 61 71 87
คุณสมบัติของอะตอม
โครงสร้างผลึก= cubic face centered
สถานะออกซิเดชัน =0
อิเล็กโตรเนกาติวิตี=ไม่มีข้อมูล (พอลิงสเกล)
พลังงานไอออไนเซชัน(เพิ่มเติม) =
สถานะออกซิเดชัน =0
อิเล็กโตรเนกาติวิตี=ไม่มีข้อมูล (พอลิงสเกล)
พลังงานไอออไนเซชัน(เพิ่มเติม) =
ระดับที่ 1: 1520.6 กิโลจูล/โมล
ระดับที่ 2: 2665.8 กิโลจูล/โมล
ระดับที่ 3: 3931 กิโลจูล/โมล
รัศมีอะตอม= 71 pm
รัศมีอะตอม (คำนวณ) =71 pm
รัศมีโควาเลนต์ =97 pm
รัศมีวานเดอร์วาลส์ =188 pm
ระดับที่ 2: 2665.8 กิโลจูล/โมล
ระดับที่ 3: 3931 กิโลจูล/โมล
รัศมีอะตอม= 71 pm
รัศมีอะตอม (คำนวณ) =71 pm
รัศมีโควาเลนต์ =97 pm
รัศมีวานเดอร์วาลส์ =188 pm
อื่น ๆ
การจัดเรียงทางแม่เหล็ก =ไม่เป็นแม่เหล็ก
การนำความร้อน =(300 K) 17.72 mW/(m·K)
ความเร็วเสียง =(ก๊าซ, 27 °C) 323 m/s
เลขทะเบียน CAS= 7440-37-1
การจัดเรียงทางแม่เหล็ก =ไม่เป็นแม่เหล็ก
การนำความร้อน =(300 K) 17.72 mW/(m·K)
ความเร็วเสียง =(ก๊าซ, 27 °C) 323 m/s
เลขทะเบียน CAS= 7440-37-1
ไอโซโทปที่น่าสนใจ
36Ar 0.337% Ar เสถียร โดยมี 18 นิวตรอน
37Ar syn 35 d ε ? 37Cl
38Ar 0.063% Ar เสถียร โดยมี 20 นิวตรอน
39Ar syn 269 y β- 0.565 39K
40Ar 99.600% Ar เสถียร โดยมี 22 นิวตรอน
42Ar syn 32.9 y β- 0.600 42K
37Ar syn 35 d ε ? 37Cl
38Ar 0.063% Ar เสถียร โดยมี 20 นิวตรอน
39Ar syn 269 y β- 0.565 39K
40Ar 99.600% Ar เสถียร โดยมี 22 นิวตรอน
42Ar syn 32.9 y β- 0.600 42K
ออสเมียม(อังกฤษ:Osmium) คือธาตุเคมีที่มีหมายเลขอะตอม 76 และสัญลักษณ์คือ Os ออสเมียมเป็นธาตุโลหะทรานซิชันสีน้ำเงินเทาหรือน้ำเงิน-ดำแข็งและเปราะอยู่ในกลุ่มของแพลตินัมออสเมียมเป็นธาตุที่มีความหนาแน่นมากที่สุดใช้ผสมกับแพลตินัมและอิริเดียม ในธรรมชาติพบออสเมียมในรูปโลหะผสมในแร่แพลตินัม ออสเมียมในรูปเต็ตรอกไซด์ใช้ย้อมเนื้อเยื่อและหมึกพิมพ์ลายนิ้วมือ โลหะผสมของออสเมียมใช้ทำหัวปากกาหมึกซึม


ข้อมูลทั่วไปของ Os
ชื่อ, สัญลักษณ์, หมายเลข=ออสเมียม, Os, 76
อนุกรมเคมี=โลหะทรานซิชัน
หมู่, คาบ, บล็อก=8, 6, d
ลักษณะ=silvery, blue cast
มวลอะตอม=190.23(3) กรัม/โมล
การจัดเรียงอิเล็กตรอน=[Xe] 4f14 5d6 6s2
อิเล็กตรอนต่อระดับพลังงาน=2, 8, 18, 32, 14, 2
คุณสมบัติทางกายภาพ
สถานะ=ของแข็ง
ความหนาแน่น (ใกล้ r.t.)=22.61 ก./ซม.³
ความหนาแน่นของของเหลวที่m.p.=20 ก./ซม.³
จุดหลอมเหลว=3306 K(3033 °C)
จุดเดือด=5285 K(5012 °C)
ความร้อนของการหลอมเหลว=7.85 กิโลจูล/โมล
ความร้อนของการกลายเป็นไอ=738 กิโลจูล/โมล
ความร้อนจำเพาะ=(25 °C) 24.7 J/(mol·K)
ความดันไอ
P/Pa 1 10 100 1 k 10 k 100 k
ที่ T K 3160 3423 3751 4148 4638 5256
ที่ T K 3160 3423 3751 4148 4638 5256
คุณสมบัติของอะตอม
โครงสร้างผลึก=hexagonal
สถานะออกซิเดชัน=±0.7(ออกไซด์เป็นกรดปานกลาง)
อิเล็กโตรเนกาติวิตี=2.2 (พอลิงสเกล)
พลังงานไอออไนเซชัน
=ระดับที่ 1: 840 กิโลจูล/โมล
=ระดับที่ 2: 1600 กิโลจูล/โมล
รัศมีอะตอม=130 pm
รัศมีอะตอม (คำนวณ)=185 pm
รัศมีโควาเลนต์=128 pm
สถานะออกซิเดชัน=±0.7(ออกไซด์เป็นกรดปานกลาง)
อิเล็กโตรเนกาติวิตี=2.2 (พอลิงสเกล)
พลังงานไอออไนเซชัน
=ระดับที่ 1: 840 กิโลจูล/โมล
=ระดับที่ 2: 1600 กิโลจูล/โมล
รัศมีอะตอม=130 pm
รัศมีอะตอม (คำนวณ)=185 pm
รัศมีโควาเลนต์=128 pm
อื่น ๆ
การจัดเรียงทางแม่เหล็ก=?
ความต้านทานไฟฟ้า=(0 °C) 81.2 nΩ·m
การนำความร้อน=(300 K) 87.6 W/(m·K)
การขยายตัวจากความร้อน=(25 °C) 5.1 µm/(m·K)
ความเร็วเสียง (ท่อนบาง)=(20 °C) 4940 m/s
โมดูลัสของแรงเฉือน=222 GPa
อัตราส่วนปัวซอง=0.25
โมดูลัสของแรงบีบอัด=462 GPa
ความแข็งโมห์ส=7.0
ความแข็งบริเนล=3920 MPa
เลขทะเบียน CAS=7440-04-2
ไอโซโทปที่น่าสนใจ
บทความหลัก: ไอโซโทปของออสเมียม
iso NA ครึ่งชีวิต DM DE (MeV) DP
184Os 0.02% >5.6 E13 y α ? 180W
185Os syn 93,6 d ε 1.013 185Re
186Os 1.58% >2.0 E15 y α 2.822 182W
187Os 1.6% Os เสถียร โดยมี 111 นิวตรอน
188Os 13.3% Os เสถียร โดยมี 112 นิวตรอน
189Os 16.1% Os เสถียร โดยมี 113 นิวตรอน
190Os 24.6% Os เสถียร โดยมี 114 นิวตรอน
191Os syn 15.4 d β- 0.314 191Ir
192Os 41.0% Os เสถียร โดยมี 116 นิวตรอน
193Os syn 30.11 d β- 1.141 193Ir
194Os syn 6 y β- 0.097 194Ir
รีเนียม (อังกฤษ: Rhenium) คือธาตุที่มีหมายเลขอะตอม 75 และสัญลักษณ์คือ Re รีเนียมเป็นธาตุโลหะทรานซิชันสีขาวเงิน รีเนียมมีสมบัติทางเคมีคล้ายแมงกานีส ใช้ประโยชน์ในการผลิตโลหะผสมรีเนียมเป็นผลพลอยได้จากการทำให้โมลิบดีนัมบริสุทธิ์และการผลิตโลหะผสมระหว่างรีเนียมและโมลิบดีนัม


ข้อมูลทั่วไปของ Re
ชื่อ, สัญลักษณ์, หมายเลข=รีเนียม, Re, 75
อนุกรมเคมี=โลหะทรานซิชัน
หมู่, คาบ, บล็อก=7, 6, d
ลักษณะ=สีขาวอมเทา
มวลอะตอม=186.207 (1) กรัม/โมล
การจัดเรียงอิเล็กตรอน=[Xe] 4f14 5d5 6s2
อิเล็กตรอนต่อระดับพลังงาน=2, 8, 18, 32, 13, 2
คุณสมบัติทางกายภาพ
ความหนาแน่น (ใกล้ r.t.)=21.02 ก./ซม.³
ความหนาแน่นของของเหลวที่m.p.=18.9 ก./ซม.³
จุดหลอมเหลว=3459 K(3186 °C)
จุดเดือด=5869 K(5596 °C)
ความร้อนของการหลอมเหลว=60.43 กิโลจูล/โมล
ความร้อนของการกลายเป็นไอ=704 กิโลจูล/โมล
ความร้อนจำเพาะ=(25 °C) 25.48 J/(mol·K)
ความดันไอ
ความหนาแน่นของของเหลวที่m.p.=18.9 ก./ซม.³
จุดหลอมเหลว=3459 K(3186 °C)
จุดเดือด=5869 K(5596 °C)
ความร้อนของการหลอมเหลว=60.43 กิโลจูล/โมล
ความร้อนของการกลายเป็นไอ=704 กิโลจูล/โมล
ความร้อนจำเพาะ=(25 °C) 25.48 J/(mol·K)
ความดันไอ
P/Pa 1 10 100 1 k 10 k 100k
ที่ T K 3303 3614 4009 4500 5127 5954
ที่ T K 3303 3614 4009 4500 5127 5954
คุณสมบัติของอะตอม
โครงสร้างผลึก=hexagonal
สถานะออกซิเดชัน=6, 4, 2, −2(ออกไซด์เป็นกรดปานกลาง)
อิเล็กโตรเนกาติวิตี=1.9 (พอลิงสเกล)
พลังงานไอออไนเซชัน(เพิ่มเติม)
ระดับที่ 1: 760 กิโลจูล/โมล
ระดับที่ 2: 1260 กิโลจูล/โมล
ระดับที่ 3: 2510 กิโลจูล/โมล
รัศมีอะตอม=135 pm
รัศมีอะตอม (คำนวณ)=188 pm
รัศมีโควาเลนต์=159 pm
ระดับที่ 2: 1260 กิโลจูล/โมล
ระดับที่ 3: 2510 กิโลจูล/โมล
รัศมีอะตอม=135 pm
รัศมีอะตอม (คำนวณ)=188 pm
รัศมีโควาเลนต์=159 pm
อื่น ๆ
การจัดเรียงทางแม่เหล็ก= ?
ความต้านทานไฟฟ้า=(20 °C) 193 nΩ·m
การนำความร้อน=(300 K) 48.0 W/(m·K)
การขยายตัวจากความร้อน=(25 °C) 6.2 µm/(m·K)
การจัดเรียงทางแม่เหล็ก= ?
ความต้านทานไฟฟ้า=(20 °C) 193 nΩ·m
การนำความร้อน=(300 K) 48.0 W/(m·K)
การขยายตัวจากความร้อน=(25 °C) 6.2 µm/(m·K)
ความเร็วเสียง (ท่อนบาง)=(20 °C) 4700 m/s
โมดูลัสของยังก์=463 GPa
โมดูลัสของแรงเฉือน=178 GPa
โมดูลัสของแรงบีบอัด=370 GPa
อัตราส่วนปัวซอง=0.30
ความแข็งโมห์ส=7.0
ความแข็งวิกเกอร์ส=2450 MPa
ความแข็งบริเนล=1320 MPa
เลขทะเบียน CAS=7440-15-5
โมดูลัสของยังก์=463 GPa
โมดูลัสของแรงเฉือน=178 GPa
โมดูลัสของแรงบีบอัด=370 GPa
อัตราส่วนปัวซอง=0.30
ความแข็งโมห์ส=7.0
ความแข็งวิกเกอร์ส=2450 MPa
ความแข็งบริเนล=1320 MPa
เลขทะเบียน CAS=7440-15-5
ไอโซโทปที่น่าสนใจ
บทความหลัก: ไอโซโทปของรีเนียม
iso NA ครึ่งชีวิต DM DE (MeV) DP
185Re 37.4% Re เสถียร โดยมี 110 นิวตรอน
สังกะสี (อังกฤษ: Zinc) คือธาตุที่มีหมายเลขอะตอม 30 และสัญลักษณ์คือ Zn สังกะสีอยู่ในตารางธาตุหมู่ 12 ชื่อในภาษาอังกฤษมาจากภาษาเยอรมันว่า Zink เป็นธาตุประเภทโลหะที่มีความไวต่อปฏิกิริยาเคมีพอสมควรกับออกซิเจนและธาตุที่ไม่ใช่โลหะ สังกะสีเมื่อทำปฏิกิริยากับกรดเจือจางจะปล่อยก๊าซไฮโดรเจนออกมา


การใช้งาน
เคลือบโลหะ เพื่อป้องกันสนิมและการกัดกร่อน เช่นใน กระเบื้องสังกะสี หรือกระเบื้องสังกะสีลูกฟูก เรียกกันในวงการช่างโลหะว่า เหล็กอาบสังกะสี หรือ เหล็กชุบสังกะสี
ส่วนประกอบในโลหะผสม เช่นใช้ในการทำของเล่น
ใช้เป็นภาชนะของถ่านอัลคาไลน์
สังกะสีเป็นสารอาหาร ที่พบได้มากในหอยนางรม และโปรตีน ถั่ว แอลมอนด์ เมล็ดฟักทอง และเมล็ดทานตะวัน
เคลือบโลหะ เพื่อป้องกันสนิมและการกัดกร่อน เช่นใน กระเบื้องสังกะสี หรือกระเบื้องสังกะสีลูกฟูก เรียกกันในวงการช่างโลหะว่า เหล็กอาบสังกะสี หรือ เหล็กชุบสังกะสี
ส่วนประกอบในโลหะผสม เช่นใช้ในการทำของเล่น
ใช้เป็นภาชนะของถ่านอัลคาไลน์
สังกะสีเป็นสารอาหาร ที่พบได้มากในหอยนางรม และโปรตีน ถั่ว แอลมอนด์ เมล็ดฟักทอง และเมล็ดทานตะวัน
 โลหะสังกะสี
โลหะสังกะสีข้อมูลทั่วไปของ Zn
ชื่อ, สัญลักษณ์, หมายเลข=สังกะสี, Zn, 30
อนุกรมเคมี=โลหะทรานซิชัน
หมู่, คาบ, บล็อก=12, 4, d
ลักษณะ=สีเทาอ่อนแกมน้ำเงิน
มวลอะตอม=65.409 (4) กรัม/โมล
การจัดเรียงอิเล็กตรอน=[Ar] 3d10 4s2
อิเล็กตรอนต่อระดับพลังงาน=2, 8, 18, 2
คุณสมบัติทางกายภาพ
สถานะ=ของแข็ง
ความหนาแน่น (ใกล้ r.t.)=7.14 ก./ซม.³
ความหนาแน่นของของเหลวที่m.p.=6.57 ก./ซม.³
จุดหลอมเหลว=692.68 K(419.53 °C)
จุดเดือด=1180 K(907 °C)
ความร้อนของการหลอมเหลว=7.32 กิโลจูล/โมล
ความร้อนของการกลายเป็นไอ=123.6 กิโลจูล/โมล
ความร้อนจำเพาะ=(25 °C) 25.390 J/(mol·K)
ความดันไอ
P/Pa 1 10 100 1 k 10 k 100 k
ที่ T K 610 670 750 852 990 (1185)
คุณสมบัติของอะตอม
โครงสร้างผลึก=หกเหลี่ยม
สถานะออกซิเดชัน=2(amphoteric oxide)
อิเล็กโตรเนกาติวิตี=1.65 (พอลิงสเกล)
พลังงานไอออไนเซชัน(เพิ่มเติม)
ระดับที่ 1: 906.4 กิโลจูล/โมล
ระดับที่ 2: 1733.3 กิโลจูล/โมล
ระดับที่ 3: 3833 กิโลจูล/โมล
รัศมีอะตอม=135 pm
รัศมีอะตอม (คำนวณ)=142 pm
รัศมีโควาเลนต์=131 pm
รัศมีวานเดอร์วาลส์=139 pm
อื่น ๆ
การจัดเรียงทางแม่เหล็ก=diamagnetic
ความต้านทานไฟฟ้า=(20 °C) 59.0 nΩ·m
การนำความร้อน=(300 K) 116 W/(m·K)
การขยายตัวจากความร้อน=(25 °C) 30.2 µm/(m·K)
ความเร็วเสียง (thin rod)=(r.t.) (rolled) 3850 m/s
โมดูลัสของยังก์=108 GPa
โมดูลัสของแรงเฉือน=43 GPa
โมดูลัสของแรงบีบอัด=70 GPa
อัตราส่วนปัวซอง=0.25
ความแข็งโมห์ส=2.5
ความแข็งบริเนล=412 MPa
เลขทะเบียน CAS=7440-66-6
สมัครสมาชิก:
ความคิดเห็น (Atom)